加入【湖南自学考试交流群】免费领取咨询考试报名策略
湖南高等教育自考课程考试概要
课程名字:物理化学(一)
课程代码:02049
第一部分 课程性质与目的
1、课程性质与特征
物理化学(一)是高等教育自考冶金工程专业的专业核心课程,它是一门依据物理学的原理和方法,运用数学办法探讨化学反应的一般规律的学科。该课程的重点、难题内容包含:热力学第肯定律在理想气体状况变化和化学反应中的应用,热力学第二定律在理想气体状况变化中的应用及隔离系统中的变化过程判断,热力学第三定律在化学反应中的应用,状况函数 ΔU、ΔH、ΔS、ΔA、ΔG的计算;等温方程判断化学反应的方向,用化学热力学办法计算反应的规范平衡常数,温度对标准平衡常数的影响,化学平衡原理在气体反应中的应用;多组分组成可变的均相系统的热力学基本方程及其应用,理想气体混合物中任意组分的化学势,标准态和参考态的概念,溶液中的化学平衡;相律在两组分气液相图、液固相图中的应用及用杠杆规则剖析两组分气液相图、液固相图;基元反应、复杂反应的动力学方程,典型复杂反应动力学剖析,温度对化学反应速率常数的影响;电解质溶液的活度,原电池热力学及其电极过程动力学;表面热力学性质,弯曲液面的特质,固-气界面的吸附用途,固-液界面吸附现象,液-气界面吸附现象,亚稳定状况;溶胶稳定性的影响原因,常见的絮凝剂,影响动电动势是什么原因,电泳现象,电渗现象,溶胶制备的办法,提纯溶胶最常用办法,胶团结构,平板式双电层理论,扩散双电层理论等。
2、课程目的与基本需要
通过本课程的学习使考生学会热力学、电化学、表面化学、胶体化学基本定义,应用热力学、电化学、表面化学、胶体化学的基本原理,对相应生产过程中的化学平衡问题和相平衡问题进行剖析;初步学会动力学基本定义,对化学反应速率的各种影响原因进行剖析;基本学会物理化学的计算办法、数据处置办法并进行合理剖析。
通过该课程的自学,培养考生学习理论常识的兴趣,突破重点和难题,为后续课程的学习打下厚实的理论基础,提升剖析问题和解决问题的能力,树立理论联系实质的科学作风。
3、与本专业其他课程的关系
物理化学(一)是冶金工程专业的专业核心课程,先修课程为:普通化学,高等数学;其后续课程为:冶金原理、化工原理、粉末冶金原理、材料科学基础、环境科学基础等。物理化学中出现的定义和理论,在后续专业课程中进一步深入健全。
第二部分 考核内容与考核目的
第一章 热力学第肯定律
1、学习目的与需要
学会系统与环境定义,系统的容量性质、强度性质、状况与状况函数、过程与渠道、内能、热、功、焓、热容等定义,热力学第肯定律的文字表述和数学表达式;知道可逆和不可逆过程的概念,状况函数的两个要紧特点,恒容热与内能变化的关系,恒压热与焓变的关系,温度对热容的影响公式,理想气体的热容值;熟练应用标准摩尔生成焓和标准摩尔燃烧焓来计算化学反应标准摩尔反应焓,应用盖斯定律计算化学反应焓,应用基尔霍夫定律计算不同温度化学反应标准摩尔反应焓,应用热力学第肯定律计算理想气体恒温、恒压、恒容、绝热等过程中DU、DH、Q和 W,计算可逆相变焓。
2、考核要点与考核目的
(一)热力学第肯定律的应用、热化学(重点)
识记:节流膨胀和焦耳实验的结论,反应进度的定义
理解:可逆相变过程与不可逆相变过程有什么区别,化学反应的热效应,盖斯定律
应用:理想气体的绝热可逆方程,用标准摩尔生成焓和标准摩尔燃烧焓来计算标准摩尔反应焓,用基尔霍夫定律计算不同温度化学反应标准摩尔反应焓
(二)热力学第肯定律、焓、热容(次重点)
识记:热的定义,功的定义,恒压热容定义,恒容热容定义,理想气体的热容值
理解:热力学第肯定律的文字表述和数学表达式,热容与温度的关系式应用:体积功的计算,理想气体恒温可逆过程体积功的计算,理想气体恒
温、恒压、恒容、绝热等过程中内能和焓变的计算
(三)热力学基本定义(一般)
识记:系统的定义,环境的定义,系统的分类
理解:系统性质的两个类别,状况函数的要紧特点,平衡态的条件,可逆过程定义
第二章 热力学第二定律
1、学习目的与需要
学会热力学第二定律的克劳修斯说法、开尔文说法,自发过程的定义,熵的概念式,孤立系统熵变表达式,理想气体恒温、恒压、恒容过程熵变计算,理想气体混合熵变计算,可逆相变过程熵变计算,用孤立系统熵变判断过程变化方向,恒温、恒容且非体积功为零条件下系统变化方向和限度的判据,恒温、恒压且非体积功为零条件下系统变化方向和限度的判据,吉布斯函数、亥姆霍斯函数的概念式;知道封闭系统热力学函数间的关系;熟练计算理想气体恒温、恒压、恒容过程的DS、DH、DU、DA和DG,可逆相变过程的DS、DH、DU、DA和DG计算,运用克拉佩龙方程及克-克方程式计算不同温度下饱和蒸充气压力的变化。
2、考核要点与考核目的
(一)熵变的计算及应用、亥姆霍兹函数和吉布斯函数、克拉佩龙方程(重点)识记:亥姆霍兹函数的概念式、吉布斯函数的概念式
理解:理想气体恒温、恒压、恒容过程熵变计算、理想气体混合熵变计算,可逆相变过程熵变计算
应用:理想气体恒温、恒压、恒容过程DA和DG的计算,可逆相变过程DA和DG的计算,运用克拉佩龙方程及克-克方程式计算不同温度下饱和蒸充气压力
(二)卡诺循环、热力学第二定律、熵、热力学第二定律的表述(次重点)识记:热机效率表达式,卡诺热机效率表达式,自发过程定义
理解:卡诺循环的四个步骤,热力学第二定律的表达式,熵与混乱度的关系式
应用:热力学第二定律的克劳修斯说法、开尔文说法
(三)热力学函数间的关系(一般)识记:麦克斯韦关系式
理解:热力学基本方程
第三章 化学平衡
1、学习目的与需要
学会用理想气体化学反应等温方程判断化学反应的方向,用标准摩尔反应吉布斯函数计算化学反应的规范平衡常数;知道化学反应的同时平衡,热力学第三定律的内容,标准熵、规定熵的概念,由标准摩尔生成吉布斯函数计算化学反应标准摩尔吉布斯函数;熟练应用理想气体化学反应等温方程,气体反应标准平衡常数的概念式,标准摩尔反应熵的计算式,不同温度的规范摩尔反应熵的计算式,用范特霍夫等压方程积分式计算不同温度下标准平衡常数,温度对气体化学平衡的影响,气态组分分压对化学平衡的影响,系统总重压对化学平衡的影响,惰性气体对化学平衡的影响。
2、考核要点与考核目的
(一)化学反应等温方程、温度对平衡常数的影响(重点)识记:标准摩尔生成吉布斯函数,吉布斯-亥姆霍兹方程理解:标准摩尔反应吉布斯函数及其与温度的关系
应用:理想气体化学反应等温方程判断化学反应的方向,用标准摩尔反应吉布斯函数计算化学反应的规范平衡常数,用范特霍夫等压方程积分式计算不同温度下标准平衡常数
(二)热力学第三定律、影响理想气体化学平衡的原因(次重点)
识记:能斯特热定理,影响理想气体化学平衡的原因
理解:热力学第三定律的内容,规定熵和标准熵定义,气态组分分压对化学平衡的影响,惰性气体对化学平衡的影响
应用:标准摩尔反应熵的计算式,不同温度的规范摩尔反应熵的计算式,系统总重压对平衡的影响
(三)各类平衡常数、同时平衡(一般)
识记:理想气体反应的规范平衡常数的概念、重压平衡常数的概念、摩尔分数平衡常数的概念、摩尔浓度平衡常数的概念,多相反应的规范平衡常数的概念,分解压定义
理解:平衡实际转化的比例公式,同时平衡的定义
第四章 多组分系统热力学
1、学习目的与需要
学会稀溶液和理想溶液中各组分在溶液上方蒸充气压力的计算办法,分配定律的影响原因,萃取的定义;知道偏摩尔量和化学势的概念,多组分组成可变的均相系统的热力学基本方程,理想气体混合物中任意组分的化学势,标准态和参考态的概念,活度的概念,活度的测定办法,规则溶液的定义,溶液反应中标准平衡常数与系统标准摩尔反应吉布斯函数的关系;熟练应用拉乌尔定律和亨利定律,稀溶液的依数性计算公式。
2、考核要点与考核目的
(一)稀溶液的气液平衡、理想稀溶液、稀溶液的依数性、理想溶液(重点)识记:稀溶液中组分的化学势计算公式,理想溶液的蒸充气压力与溶液组成的
关系,理想溶液中组分的化学势计算公式,稀溶液的蒸充气压力与溶液组成的关系
理解:分配定律,沸点上升公式,凝固点降低公式,渗透压公式,蒸充气压力降低公式
应用:拉乌尔定律和亨利定律
(二)偏摩尔性质、化学势、活度和活度系数的测定(次重点)
识记:偏摩尔性质,化学势的概念,活度的概念,标准态和参考态的概念理解:偏摩尔量集合公式,吉布斯-杜海姆方程,理想气体的化学势,活
度测定实验办法
应用:偏摩尔体积的计算,化学势在多相平衡系统中的应用
(三)超额函数与规则溶液、溶液中的化学平衡(一般)识记:超额函数定义
理解:规则溶液定义,溶液反应中标准平衡常数与系统标准摩尔反应吉布斯函数的关系
第五章 相图
1、学习目的与需要
学会相律的意思,相律在单组分、两组分系统中的应用,固相完全不互溶的共晶型二组分相图,固相完全不互溶且生成化合物的二组分相图,生成固溶体的二组分相图,热剖析法制作相图,地区熔炼,精馏原理;知道相数、组分数、自由度数等一些基本定义,单组分相图、两组分系统的气-液平衡相图、液态部分互溶型的二组分相图;熟练应用杠杆规则研究相图。
2、考核要点与考核目的
(一)固相完全不互溶的共晶型二组分相图、固相完全不互溶且生成化合物的二组分相图、生成固溶体的二组分相图(重点)
识记:固相完全不互溶的共晶型二组分相图、固相完全不互溶且生成化合物的二组分相图、生成固溶体的二组分相图
理解:热剖析法制作相图、地区熔炼应用:杠杆规则剖析气-液平衡相图
(二)单组分相图、相律、两组分系统的气-液平衡相图、液态部分互溶型的二组分相图(次重点)
识记:单组分相图、两组分系统的气-液平衡相图、液态部分互溶型的二组分相图
理解:相律、精馏原理
应用:杠杆规则剖析固-液平衡相图
(三)简单共晶型的三组分液-固相图、具备一个二组分稳定化合物的三组分液-固相图(一般)
识记:具备一个二组分稳定化合物的三组分液-固相图理解:简单共晶型的三组分液-固相图
第六章 量子力学基础
本章内容供考生选读,不作考核需要。
第七章 统计热力学
本章内容供考生选读,不作考核需要。
第八章 表面现象
1、学习目的与需要
学会表面张力定义,表面能定义,表面张力随温度变化是什么原因,四种亚稳定状况,弯曲液面的附加重压方向与曲率的关系,表面活性物质定义,表面张力变化与表面吸附的关系,表面活性物质的增溶用途,物质的表面活性与碳氢链的关系,影响固体从溶液中吸附的原因,固体对强电解质溶液吸附的规律,物理吸附与化学吸附有什么区别;知道粘附功定义,内聚功定义,各类型型的润湿与铺展过程,接触角与界面张力的关系,毛细管内液面上升高度与毛细管半径的关系,吉布斯吸附等温式;熟练应用拉普拉斯方程,开尔文方程,朗格谬尔吸附等温方程,能剖析新相难成的机理与亚稳态的形成。
2、考核要点与考核目的
(一)弯曲液面重压性质、亚稳定状况、气体在固体表面的吸附、吸附等温方程(重点)
识记:四种亚稳定状况,吸附定义,吸附量与温度和重压的关系
理解:弯曲液面的附加重压方向与曲率的关系,新相难成的机理与亚稳态的形成
应用:拉普拉斯方程,开尔文方程,物理吸附与化学吸附,朗格兰谬尔吸附等温方程
(二)润湿现象、吉布斯吸附等温方程、表面活性物质和表面膜、固体自溶液中的吸附(次重点)
识记:知道粘附功定义,内聚功定义,各类型型的润湿与铺展过程,表面活性物质定义,表面张力变化与表面吸附的关系,表面活性物质的增溶用途
理解:接触角与界面张力的关系,吉布斯吸附等温方程,物质的表面活性与碳氢链的关系,
应用:毛细管内液面上升高度与毛细管半径的关系,影响固体从溶液中吸附的原因,固体对强电解质溶液吸附的规律
(三)表面张力与表面自由能(一般)识记:表面张力定义,表面能定义理解:表面张力随温度变化是什么原因
第九章 电化学
1、学习目的与需要
学会离子的电迁移率概念,离子迁移数概念,电导率定义,摩尔电导率定义,电解质溶液的电导率与浓度的关系,电解质溶液的摩尔电导率与浓度的关系,离子独立运动定律,原电池的表示办法,双电层的构成,液接电势的消除办法,可逆电池的条件,五种电极类型,标准氢电极和标准氢电极电势,电极反应超电势概念,塔菲尔公式,理论分解电压定义,实质分解电压计算公式,析出电势概念;知道强电解质的活度和活度系数离子平均活度系数测定办法,溶液 pH值测定办法,电池反应热力学性质测定办法,微溶盐溶度积测定办法,熔盐电池定义,固体电解质电池定义,电流密度定义,浓差极化方程;熟练应使用方法拉第定律,应用德拜-尤格尔公式,运用电池反应的热力学公式计算反应吉布斯函数、反应熵、反应焓、反应热,应用能斯特方程计算电池反应电动势,剖析电极的极化,测量极化曲线。
2、考核要点与考核目的
(一)强电解质的活度、原电池热力学、电极的极化和超电势、分解电压(重点)
识记:强电解质的活度和活度系数,可逆电池,浓差电池,理论分解电压定义,实质分解电压计算公式
理解:电池反应热力学公式,电极反应超电势概念,塔菲尔公式
应用:德拜-尤格尔公式,能斯特方程,剖析电极的极化,测量极化曲线,运用电池反应的热力学公式计算反应吉布斯函数、反应熵、反应焓、反应热
(二)法拉第定律、离子的电迁移和迁移数、电解质溶液的电导率、电池电动势测定的应用、离子的析出顺序和一同放电(次重点)
识记:电导率、摩尔电导率、析出电势概念
理解:离子的电迁移率、离子迁移数概念,测定电池反应热力学性质办法,测定微溶盐溶度积办法,电解质溶液的电导率与浓度的关系,电解质溶液的摩尔电导率与浓度的关系,离子独立运动定律
应用:法拉第定律,测定电解质溶液的离子平均活度系数办法,测定溶液pH值办法
(三)原电池、电极类型和电极电势、熔盐电池、固体电解质电池(一般)
识记:原电池的表示,五种电极类型,熔盐电池概念,固体电解质电池概念,标准氢电极和标准氢电极电势
理解:液接电势的消除办法,双电层的构成,标准氢电极和标准氢电极电势,原电池的表示办法,可逆电池的条件
第十章 化学反应动力学
1、学习目的与需要
学会化学反应速率定义,基元反应、复杂反应定义,化学反应动力学数据的获得办法,化学反应动力学数据的处置办法,活化能定义,单链反应、支链反应、催化剂定义,催化反应特征;知道对峙反应、平行反应、连串反应定义,双分子气相反应的碰撞理论,过渡状况理论,光化学反应1、第二定律,光敏反应定义;熟练应用零级反应速率方程、一级反应速率方程、二级反应速率方程,应用阿伦尼乌斯方程计算不同温度的反应速率常数。
2、考核要点与考核目的
(一)反应级数是正整数的反应、典型复杂反应、温度对反应速率的影响、链式反应、催化反应(重点)
识记:对峙反应、平行反应、连串反应、单链反应、支链反应、催化剂定义理解:n 级反应速率方程,活化能,催化反应特征
应用:零级反应速率方程、一级反应速率方程、二级反应速率方程、阿伦尼乌斯方程
(二)化学反应速率方程、化学反应动力学数据的获得与处置、多相反应动力学(次重点)
识记:基元反应、复杂反应
理解:稳态扩散定义
应用:化学反应动力学数据的获得办法、化学反应动力学数据的处置办法
(三)化学反应速率、双分子气相反应的碰撞理论、过渡状况理论、光化学反应
(一般)
识记:化学反应速率定义,光化学反应1、第二定律,光敏反应定义理解:双分子气相反应的碰撞理论、过渡状况理论
第十一章 分散系统
1、学习目的与需要
学会溶胶稳定 DLVO理论,电解质的聚沉用途,影响溶胶稳定性的原因,常见的絮凝剂,电解质影响动电动势是什么原因,电泳定义,电渗定义,沉降电势概念;知道各种分散系统的性质,溶胶制备的三种办法,提纯溶胶最常见的办法,碘化银溶胶胶团结构,氢氧化铁溶胶胶团结构,硫化砷溶胶胶团结构,平板式双电层理论,扩散双电层理论。
2、考核要点与考核目的
(一)溶胶的动电性质、溶胶的光学性质(重点)识记:溶胶的动电电势、溶胶的沉降电势
理解:电泳与电渗,散射光强度的特征,丁达尔效应,瑞利公式
(二)胶体的稳定与破坏、双电层理论、动电电势的测定、高分子溶液、乳状液
(次重点)
识记:胶团结构,平板式双电池理论,电泳定义,电渗定义,沉降电势概念,高分子溶液的粘度,高分子化合物的结构、乳状液定义,影响溶胶稳定性的原因
理解:溶胶稳定 DLVO理论,扩散双电层理论,乳状液,高分子溶液的黏度,牛顿黏度和结构黏度,常见的絮凝剂有哪些用途,盐析用途
(三)溶胶系统的分类、溶胶的制备和提纯(一般)识记:溶胶系统的分类
理解:溶胶制备的三种办法,溶胶的提纯工艺
第三部分 有关说明与推行需要
1、考核的能力层次表述
本大纲在考核目的中,根据“识记”、“理解”、“应用”三个能力层次规定其应达到的能力层次需要。各能力层次为递进等级关系,后者需要打造在前者的基础上,其含义是:
识记:能了解有关的名词、定义、常识的意思,并能正确认识和表述,是低层次的需要。
理解:在识记的基础上,能全方位把握基本定义、基本原理、基本办法,能学会有关定义、原理、办法有什么区别与联系,是较高层次的需要。
应用:在理解的基础上,能运用基本定义、基本原理、基本办法联系学过的多个要点剖析和解决有关的理论问题和实质问题,是最高层次的需要。
2、教程
指定教程:物理化学(第 4 版),王淑兰,冶金工业出版社,2013 年
3、自学办法指导
1.在开始阅读指定教程某一章之前,先翻阅大纲中有关这一章的考核要点及对要点的能力层次需要和考核目的,以便在阅读教程时做到心中有数,有些放矢。
2.阅读教程时,要逐段细读,逐句推敲,集中精力,吃透每个要点,对基本定义需要深刻理解,对基本理论需要彻底弄清,对基本办法需要结实学会。
3.在自学过程中,既要考虑问题,也要做好阅读笔记,把教程中的基本定义、原理、办法等加以整理,这可从中加深对问题的认知、理解和记忆,以利于突出重点,并涵盖整个内容,可以不断提升自学能力。
4.完成书后作业和适合的辅导训练是理解、消化和巩固所学常识,培养剖析问题、解决问题及提升能力的要紧环节,在做训练之前,应认真阅读教程,按考核目的所需要的不同层次,学会教程内容,在训练过程中对所学常识进行适当的回顾与发挥,重视理论联系实质和具体问题具体剖析,解题时应注意培养逻辑性,针对问题围绕有关要点进行层次(步骤)分明的论述或推导,明确各层次(步骤)间的逻辑关系。
4、对社会助学的需要
1.应熟悉考试概要对课程提出的总需要和各章的要点。
2.应学会各要点需要达到的能力层次,并深刻理解对各要点的考核目的。
3.辅导时,应以考试概要为依据,指定的教程为基础,不要随便增删内容,以免与大纲脱节。
4.辅导时,应付学习技巧进行指导,宜倡导认真阅读教程,刻苦钻研教程,主动争取帮助,依赖自己学通的办法。
5.辅导时,应该注意突出重点,对考生提出的问题,不要有问即答,要积极启发引导。
6.注意对考生能力的培养,尤其是自学能力的培养,要引导考生逐步掌握独立学习,在自学过程中擅长提出问题,剖析问题,作出判断,解决问题。
7.要使考生知道考试试题的难易与能力层次高低两者不完全是一回事,在每个能力层次中会存在着不同困难程度的考试试题。
5、关于命题考试的若干规定
1.本大纲各章所提到的内容和考核目的都是考试内容。考试试题覆盖到章,适合突出重点。
2.试题中对不同能力层次的考试试题比率大致是:“识记”为 30%、“理解”为
50%、“应用”为 20%。
3.考试试题难易程度应合理:易、较易、较难、难比率为2:3:3:2。
4.每份试题中,各类考核点所占比率约为:重点占 60%,次重点占 30%,一般占 10%。
5.考试试题种类一般分为:单项选择题、填空题、简答卷、计算题。
6.考试使用闭卷笔试,考试时间 150分钟,使用百分制评分,60分合格。
6、题型示例(样题)
1、单项选择题(本大题共■小题,每小题■分,共■分)
在每小题列出的四个备选项中只有一个是符合题目需要的,请将它选出并将“答卷卡”上的相应字母涂黑。错涂、多涂或未涂均无分。
1.基元反应: 的反应分子数为
的反应分子数为
A.单分子反应 B.双分子反应 C.三分子反应 D.四分子反应
2、填空题(本大题共■小题,每小题■分,共■分)
1.双组分凝聚系统的相律公式是 ,最多相数为 。
3、简答卷(本大题共■小题,每小题■分,共■分)
1.亨利定律和拉乌尔定律有什么不同?
4、计算题(本大题共■小题,每小题■分,共■分)
1.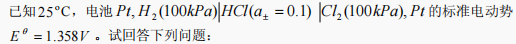
⑴写出电极反应和电池反应;
⑵计算25oC时电池电动势 E。
点击进入湖南自考培训报名网址
![]()
欢迎加入【湖南自学考试交流群】一块学习交流!群内有专业【招生老师】为大伙解惑答疑!快来一块学习进步吧!
以上就是关于《湖南自学考试物理化学(一)02049 课程考试概要》的全部内容,想知道更多湖南自学考试资讯,请持续关注《湖南自学考试网》。如有需要,考生可点击《湖南自学考试网助学报名网址》进行报名,或点击添加《招生老师微信》进行咨询解答和报名服务哦~



